临床上,病毒的感染需要进行诊断,才能提供医师治疗的依据、流行病学的讯息以及病毒感染的防治。病毒的实验室诊断方法 包括以养殖细胞分离病毒、组织学、血清学、电子显微镜观察、免疫分析以及核酸 (DNA 或 RNA)侦测等方法[1-2],操作这些方法前,
须从疑似病毒感染的患者适当的部位采集各 种检体,并尽速运送至检验室进行实验室诊 断[2]。病毒感染的诊断准确性受到各种因子。
影响:(i)检体的采检时机:检体通常在症状
出现后的 3 天内采检;(ii)采检部位的选择: 如呼吸道感染,选择利用拭子(swab)采集呼 吸道检体;(iii) 检体的方式:如采检体液或 利用拭子采检后放入无菌的空容器、小瓶(vi- als)或装有液体运送培养基(transport
medium)的容器(如试管);(iv)采检的拭子的本质:拭子的材质以植绒(flock)材质为佳[2-3],并具
有塑料或铝材质的硬柄或软柄,不可使用木 柄的棉棒,因其对养殖细胞具有毒性;也不 可使用海藻酸钙(calcium alginate)成分的拭 子,因其对含包膜 (envelope) 的病毒具有毒
性、并可干扰荧光抗体试验以及抑制一些核 酸物质而影响核酸的分子生物检测;(v)检体 的运送时间、储存环境以及 (vi) 其它:如采集技术、采集的检体量、检体标示以及患者的临床信息等[1,3]。有些病毒感染的实验室诊断是必要的, 例如检测会引起严重症状的病毒[如后天免疫
缺 乏 症 候 群 (acquired immune deficiency syndrome, AIDS)的艾滋病毒(HIV)]或是长期 的潜伏的病毒〔如长期潜伏于肝脏的 B 型肝 炎病毒(Hepatitis B virus, HBV)和 C 型肝炎 病毒(Hepatitis C virus, HCV)J;或在短时 间内能快速传播及引起高致死率的病毒,如:2003 年爆发流行的 SARS 病毒(SARS-CoV)[4]及 2019 年爆发流行的新型冠状病毒(SARS- CoV-2, COVID-19 病毒)[5]。此外,已经有
药物可以治疗的病毒感染,或为了流行病学 调查、医院感染控制、公共卫生如隔离等目 的而进行检体的采集并进行各类病毒的检测。 病毒检测检体除了体液〔如支气管肺泡 灌洗(BAL)、脑脊髓液(CSF)、尿、血液J外,
若以拭子采集的检体需放入空的无菌容器或 含有运送培养基的容器内,立即以适当的条件送至检验室或储存在适当的环境一段时间再送至检验室。因此,病毒检测检体中的抗 原、活性、病毒量与核酸将受到拭子的本质、运送培养基的成分、运送的条件、储存的时
间与环境等之影响[1,3]。为了保存病毒的活性 以及核酸,检验室有必要使用良好质量与材 质的拭子以及适当的检体运送培养基种类。
对少数引起严重疾病的病毒而言,检测 病毒必须在 P2+或 P3 甚至 P4 等级的负压实验室中进行,以 SARS-CoV 及 SARS-CoV-2而言,更是如此。然而,有此些安全等级的
实验室在医院中并不普遍,因此,对高传染 性的病毒而言,整体的检验能量将受到限制。 在 SARS-CoV-2 疫情期间,增加全国的检测
能量以早期侦测感染或潜伏的患者将有其重 要性及必要性。对不进行病毒分离培养而仅 提供核酸扩增试验的检验室而言,只要检测 检体先经去活化 (inactivate,灭活)处理,则
检测的场所仅需在 P2 等级的实验室即可进行操作,如此,将可扩展全国对 SARS-CoV-2病毒的整体检测能量。
在台湾,具有病毒检测能力的检验室虽 有能力配制一般病毒检体的运送培养基,但 其使用前大多未进行实用的效能评估或进行 效能的品管,且常没有使用正确材质成分的
拭子,有鉴于此,做新生物科技公司开发两 种病毒检测检体的运送装置:一为 CMPTM 病 毒运送保存管[viral transport medium (VTM)],另一为 CMPTM 去活化型病毒运送保存管[in- activated viral
transport medium (I-VTM)](图 1A),两者皆可搭配鼻咽及/或口咽植 绒拭子(flocked swab)。植绒拭子皆具有断点 (图 1B),可将拭子前端折进运送管内。为 了了解 VTM 与 I-VTM 辅助病毒(包含 SARA- CoV-2)侦测的效能,有必要以适当的病毒 进行实用性评估。
早期,对于运送检体装置的病毒回收率 并没有标准的方法,只有少数的研究从临床上取得的检体,经由不同运送装置来比较病毒的回收率;或是添加某种病毒检体至运送 装置,检视回收率。为了将运送培养装置的评估加以标准化,Clinical
and Laboratory Standards Institute (CLSI) M40-A2[6]提出明 确规范,包括病毒检体的种类、运输时间、
保存温度及病毒接种浓度上限范间。在规范 中,将装置保存在指定温度,仿真运输时间 (24、48、72 及
96 小时),再分别制备十倍连续稀释液,吸取 0.2 mL 接种至养殖细胞中,若产生细胞病变效应(cytopathic
effects, CPE),代表病毒具有活性,即运送装置保存 病毒的性能符合规范之要求。
本研究将根据 CLSI 建议选用第二级病毒[6]之一的肠病毒 71 型(Entrovirus
71, EV 71)进行测试,EV 71 属于微小核糖核酸病毒科 (Picornaviridae),不具包模(envelope)的单股
正股 RNA 病毒,由于不具包膜,对于环境的耐受力较高[7],且其与冠状病毒科(Coronavi-ridae)中的 SARS-CoV 与 SARS-CoV-2 皆属 于 RNA 病毒[4-5]。实验时,将 EV 71 分别与 VTM 或 I-VTM 两种运送培养基混合,保存于 三种温度,然后于不同指定时间后,分别接
种至人类横纹肌肉瘤细胞(human rhabdomyos- arcoma cell , RD 细胞)中,之后观察 CPE 及利用反转录-实时聚合醋链反应(quantitative reverse transcription PCR, qRT-PCR)侦测 RD 细胞内 EV 71 之正股及负股 RNA,其中细胞内正股 RNA 代表 EV 71 成功感染细胞,而细胞内负股 RNA 则为 EV 71 复制其 RNA 的中 间产物,可间接证明 EV 71 于 RD 细胞内复 制。另外,本研究利用 SARS-CoV-2 的三对 基因[8-9]分别与 VTM 或 I-VTM 混合,亦进行 如同 EV 71 在不同保存温度及时间条件下的 qRT-PCR 检测,以了解此 VTM 及 I-VTM 保 存 SARS-CoV-2 核酸的能力。
非洲绿弥猴肾细胞株 (vero cell line, ATCC CCL-81)及 EV 71 (BrCr, ATCC VR784)均购自食品工业发展研究所,台湾。SARS-CoV-2 的三对引子(primers)基因片段 (E gene、RdRp gene 及 N gene),购自 MicroBioLogics®(型 号: HE0062S),USA。试剂与药品一倍基本培养液 (1x minimal essential
medium, MEM)与抗生素(antibiotic-antimycin, 内含 penicillin、streptomycin、amphotericin B)购自 Corning Incorporated 公司,美国。胎
牛血清(fetal bovine serum, FBS)、膜蛋白酵 素(Trypsin)与一倍磷酸盐缓冲液(1x phosphate buffer saline, PBS)来自 GE
Healthcare 公司, 美国。甘油(Glycerol)、氯仿(chloroform)、 75% 酒精 (EtOH)、异丙醇 (isopropanol) 与 DEPC
(diethylpyrocarbonate)处理水从 Merck 公司(德国)取得。荧光定量试剂盒(FastStart
Universal SYBR Green Master)则购自 Roche 公司,瑞士。而 cDNA 反转录试剂盒 (High- Capacity cDNA Reverse
Transcription Kit)及 trizol(分离 RNA、DNA、蛋白质的试剂) 则来自 Thermo Fisher Scientific 公司,美国。
细胞培养液配制(10% MEM、2% MEM)取总体积 10%的 FBS 及 1%的抗生素的 加入 1x
MEM,此为生长培养液(10% MEM), 存放于 4C用于细胞继代及培养。取总体积 2%的 FBS 及 1%的抗生素加入 1x MEM,此 为维持培养液(2% MEM),存放于 4C用于稀 释药物及维持受病毒感染的细胞株。FBS 使 用前需在 56C水浴槽加热 30 分钟,去除血 清中补体,分装后保存于-20C备用。将 10x PBS 利用去离子蒸馏水 (double-distilled H2O, ddH2O) 稀释成 1x PBS,再经灭菌冷却后存 放于 4C备用。此外,glycerol 则以 ddH2O 稀 释成 30% glycerol,再经灭菌冷却后,存放于 4C备用。
RD 细胞培养/继代培养
RD 细胞于培养瓶中生长至 80%时,进
行继代培养。在无菌操作箱(型号:Revcoeite II)中,将经过培养的 T25 培养瓶(购自 Corning
Incorporated 公司,美国)以 3 mL 1x
PBS 润洗后去除培养液,接着加入 0.5 mL Trypsin, 混合均匀后置入 37C之 5% CO2 培养箱中放 置 1 分钟,取出培养瓶后以拍击方式震散细 胞,然后加入 4.5 mL 10% MEM 以中和 Trypsin 的继续作用,将 RD 细胞冲下并均匀 打散,接着将细胞与 10% MEM 以 1:4 至 1:9 的比例回种到新的细胞培养血中,置于 37C 之 5% CO2 培养箱培养。
EV 71 之溶斑试验
利用溶斑试验(plaque assay)测定 EV 71 浓度,实验时,将 RD 细胞培养于 6 孔细胞 培养盘中,之后以 2% MEM 将待测病毒液进 行连续 10 倍稀释后 (10-2-10-6)进行感染,其 中 1 孔为不加病毒液之阴性控制组,将细胞 置于 37C的 5% CO2 培养箱中 1 小时进行感 染。
于感染的过程中,配制等体积的 1.2%琼 脂溶液与 2x 培养液,置于 44C水浴中。待病 毒感染完成后去除病毒液,将等体积之 1.2% 琼脂溶液与 2x 培养液均匀混合后,分别于培 养盘中每一孔缓慢加入 4 mL 琼脂培养液,待凝固后,置于 37C的 5% CO2 培养箱中,于3 天后加入第二层琼脂,然后继续培养。
当产生明显 CPE 时(通常于感染后第 5 天),于每培养盘中每孔加入 1
ml 3.7%甲 醒,于 4C固定。隔天轻轻敲除 6 孔盘中的
琼脂培养基,并加入 2-3 滴的 0.5%结晶紫,染色 5 分钟后,以清水冲洗干净。当培养盘完全干燥后,受到 EV 71 感染的 RD 细胞由 于死亡脱落而无法被染上色,形成肉眼可见的空洞,称为溶斑(plaque)。藉由感染不同稀
释倍数的病毒液所造成的溶斑数目推算原始 病毒的效价 (titer),单位为 plaque forming unit (PFU)/mL,代表每 mL 病毒液可产生的 病毒溶斑数目。
EV 71 RNA 之萃取
将 1.5 mL 含有 EV 71 的培养液于 4C下1,000 rpm,离心 5 分钟,将上清液去除后加
入 1 mL 的 trizol 将沉淀物打散,将混合液移 至另一个 1.5 mL 微量离心管中,于室温静置 5 分钟,接着加入 200 μL chloroform,利用 振荡器(vortex genie 2)震荡 1 分钟,直至溶 液颜色变成粉红色后,然后再于室温静置 2-3 分钟。将离心管于 4C,12,000
rpm 离心 15
分钟后,小心吸取上层含 RNA 之透明液(至少 450 μL)移至新的 1.5 mL 微量离心管中, 然后加入 0.5 mL isopropanol 后,上下摇晃
约 10 次,将溶液混合均匀后,静置于室温 10 分钟,接着将离心管于 4C,12,000 rpm 离 心 10 分钟后去除上清液后,再加入 1 mL 的 75% EtOH 于 4C,12,000
rpm 离心 10 分钟 后小心去除上清液,将白色沉淀物(pellet)风
干至半透明后加入 20 μL DEPC 处理水回溶 沉淀物,将样本置于冰上以测定 EV 71 浓度。
反转录-实时众合 链反应(quantitative
reverse transcription PCR, qRT-PCR)反转录
PCR (reverse transcription-PCR,RT-PCR)[9]:
将萃取出之 EV 71 RNA 以 20μL DEPC 处理水 20 倍稀释,使用超威量分
光亮度计(ND-1000, NanoDrop Spectrophotometer) 测量其浓度。然后根据测得的浓度,加入 1 μg 浓度 RNA、2 μL 10x RT buffer、0.8 μL 25x dNTP Mix (100 mM)、2 μL 10x RTrandom primers、1 μL MultiScribeTM
reverse transcriptase 及 1 μL RNase inhibitor 之后补ddH2O 至总体积 20 μL,再以 25C保持 10 分钟、37C保持 120 分钟、最后 85C保持 5 分 钟的顺序循环 1 次,进行 RT-PCR。
qPCR 之操作流程[10]:将萃取出的 EV 71 RNA 进行反转录聚合醋链反应,得到的 cDNA 后进行 qRT-PCR 检测。取 5 μL cDNA、0.5 μL Forward primer (30 M)、0.5 μL Reverse primer (30 M)、25 μL FastStart Universal SYBR Green Master 及 19 μL ddH2O 置 入 StepOnePlusTM real-time-PCR 仪 器 (Thermo
Fisher Scientific 公司,美国)中 扩增 40 次进行量测,利用 StepOnePlusTM 之 内建软件进行荧光侦测,再将侦测到的讯号
转换为数值,并以 GAPDH 为内部控制组, 将各组待测基因之 CT 值标准化以取得企CT 值,而后实验组扣除控制组之企CT 值,得到企企CT。2-企企CT
则可表示不同组别之待测基因与控制组之基因相对表现量。
Primer:
EV 71 RNA Positive strand
F:
(GAGAGTTCTATAGGGGACAGT)
R:
(AGCTGTGCTATGTGAATTAGGAA) Negative strand
F:
(ACTGTCCCCTATAGAACTCTC)
R:
(TTCCTAATTCACATAGCACAGCT)
VTM 与 I-VTM 的效能评估
效能评估时,将 EV 71 分别与 VTM 或 I- VTM 混合,然后保存在 3 种温度,在不同保
存时间后接种 RD 细胞, 观察 EV 71 的活性 (有能力产生 CPE)以及侦测核酸的存在(能被 qRT-PCR 方法检出)。根据 CLSI M40-A2 建 议的病毒检体运送装置评估标准[6],本研究使
用的 EV 71 原液浓度为 1x106 PFU/mL,在 保存型 VTM 组别中将培养基中病毒浓度稀释 至 2x105 PFU/mL,取 0.2 mL 病毒加入 2 mL VTM 中(约 1.8x104
PFU/mL);另外 I-VTM 组别,取 50 L 病毒与 50 L I-VTM 混合后 放入离心管中 (约 5x105
PFU/mL)。个别在4C、-80C及室温存放。由于在台湾,交通
运送便利且距离较近,病毒检体运送时间短, 且通常存放在 4C。所以在 4C组别中增加 6 小时及 24 小时两个组别,以仿真病毒检体实 际运送状况。保存在 4C分为 6、24、48、72 及 96 小时共 5 组,而保存在-80C及室温为48、72 及 96 小时共 3 组。此外,为了确认 I-VTM 裂解病毒的能力,额外将 EV 71 接种于 I-VTM 中存放 10 分钟、30 分钟、1、2、3 及 4 小时,然后接种 RD 细胞并观察 CPE。
当 EV 71 接种至 VTM 存放至预设的时
间点后,VTM 组别分别取 0.2 mL(约 103 PFU)接种至 RD 细胞中,再加入 0.2 mL 2% MEM 进行混合,而 I-VTM 组别则取 40 L, 加至 9.96 mL 2% MEM,稀释后(约 2x103PFU/mL)取 1
mL(约 2x103 PFU)接种至RD 细胞中。随后,将接种 EV 71 的 VTM 及I-VTM 组别分别放置于 37C之 5% CO2 培养 箱培养中,1 小时后,移除细胞培养液,以 1x PBS 润洗过后,再加入 2% MEM,然后 分别培养 48 及 72 小时,最后以倒立式显微 镜观察 CPE。同时,将只加入 VTM 或 I-VTM 作为保存液之 RD 细胞及含有 2% MEM 的 RD 细胞分别作为阴性控制组。培养至指定时间 后,分别观察 RD 细胞的 CPE 及操作 qRT-
PCR 以分析 VTM 或 I-VTM 的效能。
VTM 或 I-VTM 保存 EV 71 与 SARS-CoV-2
核酸的测试
为了确认 EV 71 与 SARS-CoV-2 的 RNA 可以直接保存在 VTM/I-VTM 中,本研究分 别取 1 L EV 71 (1x106 PFU/mL) 加至 1 mL VTM 或 I-VTM 中(约 1x103 PFU/mL),以及取 10 uL
SARS-CoV-2 检测所用的 E、 RdRp 及 N 基因片段之混和库存液(mix stock),分别保存在 4C、-80C及室温,然后存放至24 及 96 小时,最后再抽取两种病毒之核酸进行 qPCR 检测。
结 果
在不同温度及时间下 VTM 保存 EV 71 活性与 核酸的状况
本研究将 EV 71 保存于 VTM 中,然后
于特定的时间点时移种至 RD 细胞中进行培 养,经过 72 小时后观察细胞形态,并与未接
种 EV 71 之 RD 细胞进行比较。相较于控制 组,无论在 4C、室温及-80C,RD 细胞皆
呈现皱缩、变圆、出现空泡、凝聚、和脱落 等现象(图 2A),此结果显示 RD 细胞发生 CPE(表 1),代表 EV 71 具有活性。另外, qRT-PCR 检测 RD 细胞内 EV 71 之正股与负 股 RNA 片段,结果皆呈现阳性(表 1),此
指出 VTM 可良好保存病毒之核酸。
在不同温度及时间下 I-VTM 去除 EV 71 活性 与保存 EV
71 核酸的状况
本研究将 EV 71 保存于 VTM 中,然后
于特定的时间点时移种至 RD 细胞中进行培 养,经过 72 小时后观察细胞形态,并与未接
种 EV 71 之 RD 细胞进行比较。结果显示在 4C、室温及-80C细胞皆无 CPE(图 2B)。 同时利用 qRT-PCR 检测细胞内 EV 71 正股及
负股 RNA 片段,观察细胞内病毒核酸保存情形,结果皆呈现阴性(表 1),显示 I-VTM 可以去除病毒活性(感染力)。同时观察将 EV 71 保存于 I-VTM 中于三种不同时间点 (4C、 室温及 -80C)保存 10 分钟、30 分
钟、1、2、3 及 4 小时,结果显示 4C及室温 于 2 个小时可以完全去除 EV 71,而-80C仅 需 30 分钟即可(表 2 与图 3)。
VTM/I-VTM 在不同温度及时间下保存 EV 71及 COVI-19 病毒核酸的状况
在临床检验中,由于检体采集包含组织、 疲液、血液及粪便等不同样本,为了确保 VTM 及 I-VTM 能直接保存核酸样本,将 EV 71 与 SARS-CoV-2 检测所用的 E、RdRp 及 N基因片段加入 VTM 及 I-VTM 中于 4C、室 温及-80C各别保存 24 及 96 小时,利用 qRT-
PCR 检测 EV 71 核酸及 SARS-CoV-2 基因的
讯号。结果显示 VTM 及 I-VTM 至少可保存 病毒核酸至 96 小时(表 3)。
讨 论
自患者检体中分离病毒的方法为病毒疾 病诊断法之一。含有液体的检体,例如脑脊 髓液、尿液、及粪便检体可直接置于无菌的 容器中送到病毒检验室。必须以拭子采集的
检体如喉咙、鼻咽、直肠等,则须将采集检 体后的拭子立刻放入无菌的运送培养基中。 病毒检体运送培养基至少具有三个功能[11]:
(i)提供给水分,防止干燥将病毒去活化(inac- tivated)。(ii) 含 有 蛋 白 质 稳 定 剂 (protein stabilizer) 以保持拭子上病毒的活性。以及 (iii)含有抗生素而可抑制采检时受到采检部 位栖息细菌和其菌的污染。无论是否使用运 送培养基装置,所有的检体须立刻送到检验
室,因为病毒在活细胞外十分不稳定。
冠状病毒中 SARS-CoV 与 SARS-CoV-2 都是属于传染力极强的飞沫传染病毒,感染 者都会伴随着严重的呼吸道症状及高致死率 前者于 2002-2003 共造成全球 8,096 例感染, 其中 774 例死亡,致死率为 9.56%;而后者 于 2019-2020/9 月中共造成全球 3,131 万人感 染,其中 96.6 万人死亡,致死率为 3.09% [12],且两种病毒有最长 10 及 14 天的高感染 力潜伏期。面对传播如此快速又高致死率的 病毒,临床上有效且安全地筛检 COVID-19 确诊患者将是一项重大的考验。
病毒的聚合醋 链反应 (PCR)检测,不能 含有外来的 DNA/RNA 及 DNases/RNases, 但棉拭和海藻酸盐棉拭均存在这些醋,将会
抑制 PCR 反应[3]。VTM 或 I-VTM 所附带的 拭子均为植绒的吸头,其为聚瞌胺的一种, 植绒纤维束间的毛细管作用促进了液体样品
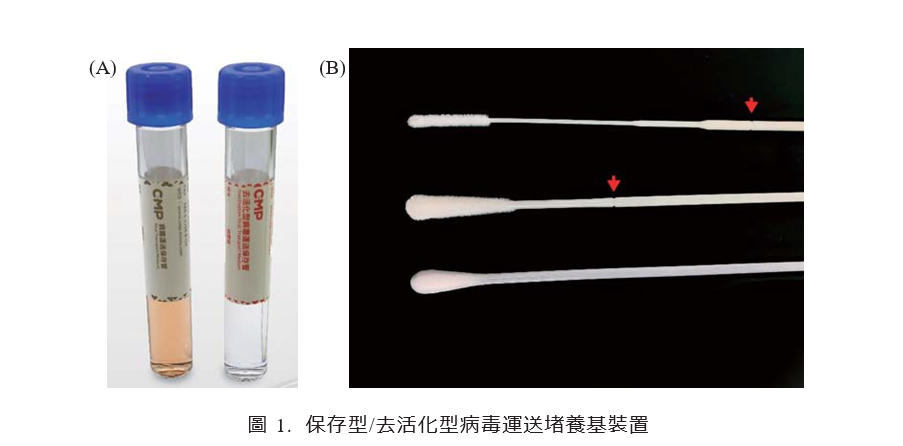
(A) CMPTM 病毒运送保存管[viral
transport medium (VTM,左方橘色培养液)]与 CMPTM 去活化型病毒运送保存 管[inactivated viral
transport medium (I-VTM,右方透明培养液)],两者皆可搭配鼻咽及/或口咽植绒拭子(flocked swab);(B)由上到下分别为 nasopharyngeal flocked swab(鼻咽植绒拭子)、oropharyngeal flocked swab(口咽植 绒拭子)及一般人造丝棉棒。植绒拭子皆具有断点(红色箭头处),可将拭子前端折进运送管内。
表 1. EV 71 分别接种于 VTM 或 I-VTM 中在不同温度及储存时间下对 RD 细胞产生 CPE 及 RD
细胞内核酸检测结果
|
于存溫度/于存時間 |
Control(控制組) |
4C |
RT |
-80C |
|||||||||
|
|
Medium only |
EV 71 only |
6 hr |
24 hr |
48 hr |
72 hr |
96 hr |
48 hr |
72 hr |
96 hr |
48 hr |
72 hr |
96 hr |
|
測試產品 |
VTM |
||||||||||||
|
CPEa |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Positive strandb |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Negative strandC |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
測試產品 |
I-VTM |
||||||||||||
|
CPEa |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Positive strandb |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Negative strandC |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
aCPE: +,代表 RD 细胞产生细胞病变 (CPE); -,代表 RD 细胞无 CPE;bPositive strand: +,表示样品中含有 EV 71 颗粒。-, 表示样品中无 EV 71 颗粒;CNegative
strand: +,代表 EV 71 核酸进行复制; -,代表 EV 71 核酸无进行复制。 缩写:VTM,病毒运送保存管;I-VTM 去活化型病毒运送保存管;RT,室温。
的强力吸收,且将样品吸附在靠近表面的位 置,因此,易再溶于液体中。因此,植绒拭 子可有效收集和释放包括细胞在内的颗粒物 [13],适合采检含有病毒的检体[1-3]。适当的运 送培养基的组成对保护检体中病毒免受环境损伤,维持病毒活性极其重要[11]。实际上,病毒的传染性会随着时间的流逝而降低,且衰减率通常与于存温度有关[14],藉由冷藏可
维持其核酸稳定性。采集含有较多病毒颗粒 的细胞培养物及缩短病毒检体的运送与接种 时间,将会增加成功分离病毒的可能性,此 对高危险性传染病毒的精准诊断将有所帮助。
本研究将 EV 71 保存于 VTM 中,结果发现无论是 4C、室温及-80C保存于指定时间点

图 2. EV 71 分别接种于 VTM 或 I-VTM 中在不同温度及时间财存后戚染 RD 细胞所显示的细胞形态
图中包括含阳性控制组(PC: virus)、阴性控制组(NC: medium)与实验组(4C、RT 及-80C)之细胞形态。显微镜 (200x)观察。(A) VTM 的阴性控制组显示细胞完整,无细胞病变(CPE);阳性控制组与实验组在所有温度及时间下
皆发现 CPE:细胞呈现皱缩、变圆、出现空泡、凝聚、和脱落等现象(箭头)。(B) I-VTM 的阴性控制组与实验组 细胞皆无 CPE,而阳性控制组则有 CPE。
缩写:VTM,病毒运送保存管;I-VTM
去活化型病毒运送保存管;RT,室温。
后(最久 96 小时)接种于 RD 细胞,结果显 示 RD 细胞皆呈现 CPE;此外,检测细胞内正股及负股 RNA 亦皆呈现阳性,显示 VTM 可
以良好保存病毒活性(表 1
和图 2A)。当 EV 71 保存于 I-VTM 中,无论是 4C、室温及-80C 保存于指定时间点后接种于 RD 细胞,结果显 示细胞皆无呈现 CPE,细胞内的 EV 71 正股及 负股 RNA 亦皆呈现阴性(表 1 与图 2B),此
指出 EV 71 丧失活性。另外研究亦指出 I-VTM 可于 2 小时完整的去除 EV 71 活性(表 2 和图 3)。此外,将 EV 71 与 SARS-CoV-2 的片段
表 2. 接种 EV 71 于 I-VTM 在不同温度下时 存不同时间裂解病毒(不产生 CPE)的效能
|
时间 温度 |
10 min |
30 min |
1 hr |
2 hr |
3 hr |
4 hr |
|
4C |
+* |
+ |
+ |
- |
- |
- |
|
RT |
+ |
+ |
+ |
- |
- |
- |
|
-80C |
+ |
- |
- |
- |
- |
- |
*+,表示接种到 RD 细胞后于 72 小时内出现细胞病变
(CPE);-,表示未出现 CPE。
缩写:I-VTM 去活化型病毒运送保存管;RT,室温。

图 3. 接种 EV 71 于 I-VTM 中储存不同温度 及不同时间后分别移种 RD 细胞所显示 EV 71 不产生 CPE(丧失活性)的情形
图中包括含阳性控制组 (PC: virus)、阴性控制组 (NC: medium)与实验组 (4C、RT 及-80C)之细胞形态。显 微镜 (200x)观察,箭头代表产生 CPE 细胞。结果显示 控制组细胞完整无 CPE,而实验组中于存在-80C,1 小时后以及于存在 4C及 RT(室温),2 小时后完全 无 CPE(代表 EV
71 丧失活性)。
缩写:I-VTM 去活化型病毒运送保存管;RT,室温。
表 3. VTM 与 I-VTM 在不同温度下保存 EV 71 及 SARS-CoV 2 核酸情形
|
時間
溫度 |
EV 71 RNA |
SARS-CoV 2 基因片段 (E gene、RdRp gene 及 N gene) |
||||||
|
VTM |
I-VTM |
VTM |
I-VTM |
|||||
|
4C |
24 hr |
96 hr |
24 hr |
96 hr |
24 hr |
96 hr |
24 hr |
96 hr |
|
4C |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
RT |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
-80C |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+,表示样品中含 EV 71 或 SARS-CoV-2 核酸,可被 qRT-PCR 检出。
缩写:VTM,病毒运送保存管;I-VTM 去活化型病毒运送保存管;RT,室温。
基因直接加入 VTM/I-VTM 中于 4C、室温 及-80C保存 24 及 96 小时,然后进行两种病 毒的核酸侦测,结果皆为阳性,指出 VTM/I-
VTM 皆可完整保存病毒的核酸(表 3)。
上述结果显示 VTM 或 I-VTM 不论在 4C、室温及-80C皆可以在指定时间内有效 保存病毒的可检测性,其中 VTM 为保存型 运送管,可以完整保存病毒的活性,以利后续的体外活体细胞培养、抗原检测、核酸检测.等鉴定及研究用途,而 I-VTM 的特点则 在于运送过程中(2 小时)即可裂解病毒颗 粒,仅保存核酸供作核酸检测,而不具感染 能力,其设计目的为增加临床第一线检测人
员的安全,降低感染风险。根据本研究所获 得的数据显示,做新生物科技有限公司生产 的 VTM 及 I-VTM 可做为临床检验室选用病 毒检体运送装置的参考
。