前言
金黄色葡萄球菌(Staphylococcus aureus) 及其肠毒素可经由食品媒介引起肠胃炎,为
食物中毒的主要致病原之一[1, 2]。中国大陆国 家标准金黄色葡萄球菌检验公告方法[3]建议 使用血琼脂平板(BAP,以TSA或Columbia agar为基础培养基)作为分离培养基。另外, 临床微生物检验室常用TSA所配制的BAP接 种临床检体[4],以便初步识别不同溶血型式的分离菌。
此两种检验室之所以使用BAP, 系因为可利用此菌在BAP的 溶血性( -hemolysis)作为生长菌落的识别[3, 4],BAP上菌落 的 溶血性系因为其中的红血球被能够产生溶 血素(hemolysin)的S. aureus所分解而破裂, 造成溶血现象,因此,菌落周围将呈现环状
透明[4]。 由于BAP配制所使用的基础培养基因应 用对象不同而异,并且同种类菌不同菌株在
含有不同基础培养基BAP的溶血能力是否相 同,将是临床检验室或食品厂品管室检验人 员极欲了解的问题,目前,用于配制BAP的 基础培养基种类包括 Tryptic Soy Agar-II
(TSA-II)、Columbia
Agar、Brucella Agar以 及brain
heart infusion agar (BHIA),配制后 倒平板前,再添加5~10%绵羊血。其中,含 TSA-II的BAP用于培养一般常见的细菌及酵 母菌,含Columbia Agar的BAP用于培养嗜 氧性与兼性厌氧菌以及绝对厌氧菌,含Brucella Agar之BAP用于分离厌氧菌,而BHIA 则常用于分离真菌[5]。 在检验室,不同链球菌常利用其生长菌 落在BAP呈现的溶血型做为菌种或不同血清 群的初步鉴定依据[6],一般 溶血型B群链球 菌(Group B streptococci,GBS)在 BAP的生 长菌落具有溶血性,但占约3~5%的 溶血型 B 群链球菌却无法在BAP呈现明显溶血性[7, 8],因此,需要含有溶血加强剂才能诱导不 溶血的 GBS 菌落产生
溶血,否则易导致其 漏检[9]。由于临床上S. aureus亦可能出现侏
儒变异株(dwarf variant),其对营养需求较 高,在BAP上常形成微小的菌落,而且通常
不具 -溶血型[10, 11]。有鉴于此,本研究以添 加与不添加溶血加强液至含不同基础培养基 (TSA-II、Columbia agar、Brucella agar 与 BHIA)之BAP探讨是否会对S. aureus ATCC 25923与 ATCC 6538溶血能力产生影响。
材料与方法
菌株制备 本研究使用 S. aureus ATCC 25923与 ATCC 6538作为培养基生长效能测试的标准 菌株,菌株保存于-70℃,研究操作前,将上
述菌株移种至 BAP(启新生物科技有限公 司,新北市),培养于35±1℃培养箱中18~24 小时,共接种两次以活化菌株。之所以选择 此两种菌株做为研究对象,系因ATCC 25923 为临床[4]以及中国大陆国标食品微生物学检 验:金黄色葡萄球菌检验建议的标准菌株[3], 而 ATCC 6538则为美国药典[12, 13]及中华药 典[14, 15]之无菌试验法及非无菌产品中之特定微生物检验法建议的标准菌株。S. aureus ATCC 25923菌落在BAP上的菌落颜色为白 色,形状为圆形、凸起典型菌落,而 ATCC 6538菌落颜色则为黄色,亦呈圆形、凸起, 两种菌株的菌落大小相近。
培养基 本研究使用的各种基础培养基均添加5% 绵羊血而制成 BAP,基础培养基包含:(i) TSA-II、TSA-II+(TSA与 TSA-II+分别代表 未添加及添加溶血加强液之BAP);(ii) Columbia agar、Columbia agar+(Columbia agar、 Columbia agar+分别代表未添加及添加溶血 加强液之BAP);(iii) Brucella agar、Brucella agar+ (Brucella
agar、Brucella agar+分别代 表未添加及添加溶血加强液之 BAP);(iv) BHIA、BHIA+(BHIA与 BHIA+代表未添加 及添加溶血加强液之BAP),这些含有各种 基础培养基的BAP均购自启新生物科技有限 公司(新北市,台湾)。
测试菌悬浮液的制备 首先将新鲜生长S. aureus两种菌株的生 长菌落分别以接种环挑取,然后移种至5 mL Tryptic Soy Broth (TSB)中,悬浮液调整至相 当于McFarland
No. 0.5的标准浓度,并以分 光亮度机测量调整其optic density (O.D.)值至 0.08~0.1之间,此时菌数约为1.5×108 CFU/ mL,接着进行十倍序列稀释5次至约103 CFU/ mL后,然后进行各种BAP的溶血试验。
溶血性试验 以微量吸管分别吸取两种菌株的菌液0.1 mL 单独地加至 TSA-II、TSA-II+、Columbia
agar、Columbia agar+、Brucella
agar、Brucella agar+、BHIA 与 BHIA+ 所配制的 BAP,再以 无菌玻棒均匀涂抹,操作二重复。将所有接
种的BAP倒置培养于35±1℃培养箱,24±2小时后观察所有BAP上生长菌落大小、溶血圈
大小,并进行菌落计数,然后比较未添加与 添加溶血加强液对两菌株生长菌落溶血圈大 小的影响。以游标尺测量5 个单一菌落溶血
圈大小(cm)后加以平均,且计算标准偏差。本 研究以TSA-II血平板溶血圈大小作为对照组 (100%)比较两种菌株在各种BAP的溶血能力。
结果
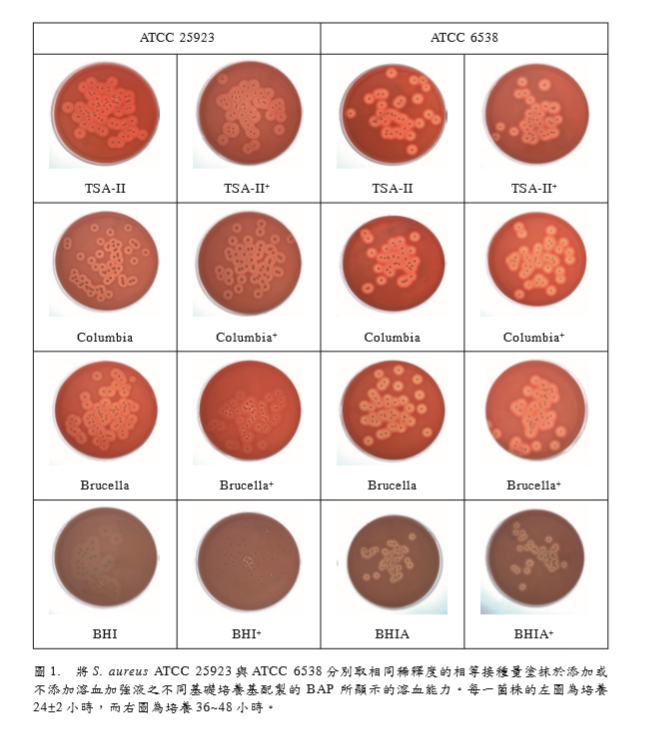
测试 S. aureus ATCC 25923与 ATCC
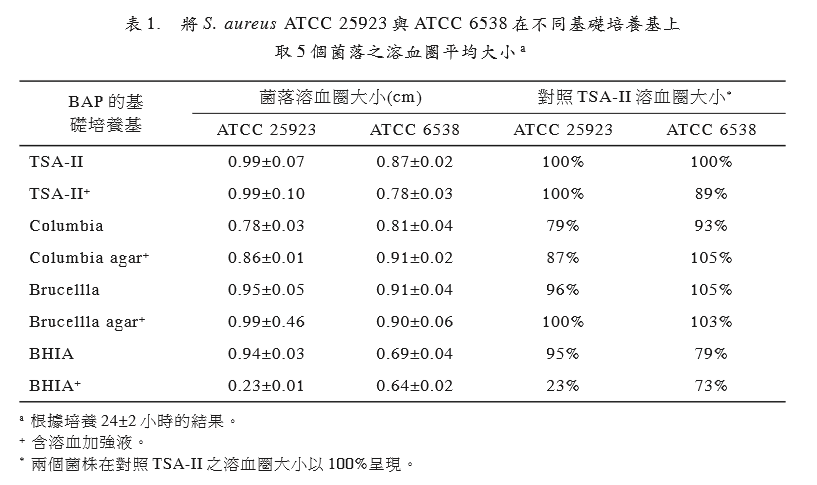
6538两菌株在各个BAP (TSA-II、TSA-II+、 Columbia agar、Columbia agar+、Brucella agar、Brucella agar+、BHIA与 BHIA+)的菌 落数,选择可计数的25~100 CFU 范围,这 些BAP的平均菌落数落差都在30% 以内(图 1),此指出两菌株在各种 BAP 的生长效能 差别甚少[16],且各个BAP上生长菌落的大小 相近,并不受基础培养基的成分差异与溶血 加强液添加与否的影响,但溶血圈大小却受 到菌株种类与基础培养基成分的影响。 ATCC 25923 在含 TSA-II,TSA-II+, Brucellla agar与 Brucella agar+ 的 BAP与对 照组TSA-II溶血圈大小相近,而Columbia+ 的溶血圈虽然大于Columbia者,但与对照组 TSA-II比较,还是较小。另外,结果指出此
菌株在BHIA+上生长菌落的溶血能力最差, 此指出加入溶血加强液,反而会抑制此测试 菌株的溶血能力。(表1) ATCC 6538在含Columbia+与 Brucellla agar的 BAP与对照组含TSA-II的 BAP上生 长菌落的溶血圈大小无太大差异,然而,在 含 BHI与 BHI+者比含TSA-II的 BAP对照组 减少约25%,且溶血圈被抑制更为明显,尤 其是添加溶血加强液者更为显著。(表1)
讨论
S. aureus因含有溶血素( 、 、 、 毒 素)而可溶血红血球,因此在BAP上的生长菌落具有完全( -)溶血性质,此特性可作为 初步鉴别此菌的依据之一[3, 4],因此,BAP 上生长菌落所显现的溶血性直接影响检验人 员的判读,由于S. aureus为临床感染及食品
中毒常见的病原菌之一,因此,更需要依据 溶血圈作为初步鉴别。台湾卫福部食药署食 品金黄色葡萄球菌之检验,只建议使用BP培
养基(Baird-Parker medium)平板[17],而中国
大陆国标方法则建议使用BAP 与 BP平板作 为初步分离食品检体中的S. aureus[3]。 本研究计算BAP上生长菌落溶血圈大小 时,皆选择菌落数25~100 CFU/平板的单一 菌落作为量测目标,此系为了避免生长菌落 过多,溶血圈互相干扰而影响其等的量测。 从 BAP 的基础培养基成分分析, TSA-II、 Columbia agar、Brucella agar都含有胰消化 蛋白胨(pancreatic digest of casein)作为氮素 源,氯化钠作为细菌生长环境酸碱变化的缓 冲剂,并维持渗透压。其中,TSA-II额外添 加生长因子,Columbia agar添加牛浸心液与 玉米淀粉,而Brucella agar则含有亚硫酸氢 钠[5]。S. aureus虽然可在含BHI成分的BAP 上生长,但其溶血能力不佳,研究结果发现 测试的两种菌株在含BHIA与 BHIA+的 BAP 上溶血圈的大小都会下降,尤其是添加溶血 加强液者反而更会被抑制。另外,ATCC 6538 于添加溶血加强液之Columbia agar+ 上所出
现的溶血圈虽然比未添加者大些,但并不显 着。 虽然S. aureus有些菌株生长菌落的外观 属于侏儒变异株(dwarf variants),通常菌落 微小,不产生溶血[9, 10],是否可藉由溶血加
强液的添加至BAP加以识别,值得未来加以 探讨。 综合上述,吾等认为(i) 含TSA-II、Columbia agar、Brucella agar基础培养基的BAP 均可提供S. aureus生长菌落之明显 -溶血性 而有助于其鉴别。(ii) 添加溶血加强液对 S.aureus 生长菌落之溶血圈大小与未添加者间
并无差异。(iii) 以 BHIA与 BHIA+基础培养 基所配制的 BAP 不适用于 S. aureus 生长菌 落之鉴别,添加溶血加强液甚至会抑制此菌的溶血能力,因此,无论在食品或临床检验 上,只需用以 TSA-II、Columbia agar、 Brucella agar基础成分培养基配制的BAP进 行 S. aureus的分离及鉴别。
参考文献
1. Le Loir Y, Baron F, Gauitar M. Staphylococcus aureus and food poisoning.
Genetics and Molecular Research 2003; 2.1:7-28. 2. 行政院卫生福利部食品药物管理署。金黄色葡萄球
菌 Staphylococcus aureus食品中毒。https://www.fda.
gov.tw/tc/siteContent.aspx?sid=1937。2010。 3. 中华人民共和国国家标准化管理委员会。食品安全 国家标准 食品微生物学检验:金黄色葡萄球菌检验。 GB 4789.10-2016。国家食品药品监督管理总局,中 华人民共和国。 4.
Becker K, Skov RL, Von Eief C. Staphylococcus, Micrococcus and other
catalase-positive cocci. In Jorgensen JH, Pfaller MA, Carroll KC, Funke G,
Landry ML, Richter SS, Warnock DW (eds). Manual of Clinical Microbiology. 11th
ed., 2015:44-53. ASM press, Washington DC, USA. 5. Becton, Dickinson and
Company (BD). DifcoTM and BBLTM Manual of Microbiological Culture Media. 2009:
90-2;103-4; 155-8; 567-8; 574-6. Sparks, Maryland, USA. 6. Sharma R, Gupta A.
Differentiation of oral streptococcal species by hemolysis in blood agar medium
in vitro. Microbiological reviews 1991; 3.4:733-51. 7. Verani JR, McGee L,
Schrag SJ. Prevention of perinatal
group B streptococcal disease revised
guidelines from CDC, 2010. MMWR Recomm Rep 2010; 59:1-32. 8. Chen TC, Wei CC,
Wang YJ et al. Improving GBS screening efficiency by modern tools application.
Poster PD-50. 2014 IFBLS & The 31st World Congress of Biomedical Laboratory
Science. Program book. 2014:79. 9. 蔡文城、叶卜硕、蔡伟勋、洪晟峯、王彦博、蔡岳 廷、吕旭峯。CMPTM ß/ GBS Detection Agar: 一种 侦测B群链球菌
溶血型菌株的创新培养基。检验及 品保杂志2015; 4:16-22。 10.
SlifkinML,MerkowP,KreuzbergerSAetal.Characterization of CO2-depentent
microcolony variants of Staphylococcus aureus. Am J Clin Pathol 1971;
56:584-92. 11. Sompolinsky D, Geller ZE, Segal J. Metabolic disorders in
thiamineless dwarf strains of Staphylococcus aureus. J Gen Microbiol 1967;
48:205-13. 12. U.S.PharmacopeiaNationalFormulary.<62>Microbiological
examination of nonsterile products: tests for specified microorganisms. USP 42.
2019:6393-402. USP. 13. U.S. Pharmacopeia National Formulary. < 71>Sterility
tests. USP 42. 2019:6407-14. USP. 14. 卫生福利部。<7001>无菌检查法。中华药典,8th ed. 2016:289-95。台湾。 15. 卫生福利部。<7007.2>特定微生物检验法。中华药 典,8th ed. 2016:300-6。台湾。
16. U.S. Pharmacopeia National Formulary.
< 2021>Microbial enumeration tests: nutrition and dietary supplements.
USP 42. 2019:8509-14. USP. 17. 行政院卫生福利部食品药物管理署。食品微生物之检验方法-金黄色葡萄球菌之检验。2013 年 9 月 6 日 部授食字第1021950329号公告修正。卫生福利部食
品药物管理署,台湾。